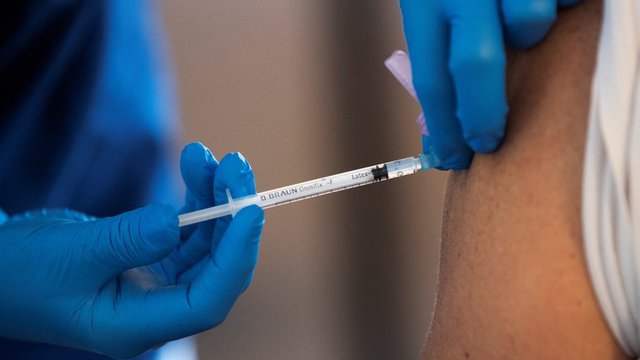
Европейската комисия заяви във вторник, че обмисля ваксини срещу COVID-19 да бъдат одобрявани по по-облекчена процедура от сегашната. Но това означава, че държавите, които ги искат, ще поемат отговорността за последствията.
Става дума за механизъм, който не е разрешение за използване на ваксина, а разрешение временно да се използва ваксина, която не е одобрена от Европейската агенция по лекарствата (ЕМА).
Иначе казано, ако правителството на България иска да внася и поставя китайски и руски ваксини, ЕМА но не иска това да става без решение на европейската агенция, може да подкрепи да се позволи на ЕМА въпросното спешно разрешение за ваксини, но и трябва да поеме цялата отговорност за инжектирането на населението с такъв продукт. Компаниите производители и ретулаторите се освобождават напълно от съдебна отговорност.
Новината съобщи "Ройтерс" и напомни, че въпросната процудера на emergency approval в момента се прилага при изключителни случаи за употреба на национално ниво на медикаменти за неизлечимо болни пациенти, включително за третиране на рак.
За ваксини в момента действа "условно пазарно разрешение" (conditional marketing authorisation), което е по-консервативен и предпазлив подход. Той е с повече проверки и по-строги изисквания, поради което отнема в най-добрия случай седмици и месеци наред.
Ако се случи подобна промяна при одобряването на ваксини, това би било голям поврат, коментира "Ройтерс". Но и в същото време Европейската комисия и ЕМА са под растящ натиск да ускорят издаването на разрешения, които идват по-бавно, отколкото в САЩ или Великобритания.
Една от основните разлики между ЕМА и другите два регулатора е, че европейската агенция поставя акцента върху безопасността на пациентите, докато в САЩ и Великобритания се следи компаните да поддържат високи стандарти, проследява се работата им в реално време и не се пречи на клиентите им да извличат ползи за здравето си.
"Готови сме да обмислим със страните членки всички възможни начини наистина да ускорим одобряването на ваксините", заяви говорител на Еврокомисията на пресконференция. Според него един от вариантите е "спешно разрешение за ваксини на ниво ЕС и споделена отговорност между страните членки" - нещо, по което може скоро да започне работа, ако 27-те правителства подкрепят идеята.
Пред "Ройтерс" говорителят допълва, че не е ясно дали една такава процедура - ако бъде одобрена - ще следва същите условия като тези при одобряване на продукт на национално ниво.
ЕМА не може да издава спешни разрешения за ваксини, но при изключителни обстоятелства е препоръчвала за лекарства т.нар. употреба от съчувствие. Така се допуска неразрешено лекарство - дори още докато се разработва и протоколът му за безопасност не е окончателно изчистен - при стриктни условия и само за групи пациенти, за които няма подходящи терапии и не могат да бъдат включени в програми за клинични изпитания. Това не означава, че с хората - макар и страдащи отдавна от животозастрашаващо ги заболяване - се правят опити, защото медикаментът трябва да е в изпитателна фаза или производителят му да е подал молба за разрешение да излезе на пазара. Така се случи през април за употребата на remdesivir на компанията Gilead за прилагане от лекари в интензивните отделения на страдащи от COVID-19. По-късно за този продукт бе издадено условно одобрение.
ЕС може спешно да одобрява ваксини, но отговорността ще е на страните, които ги искат
Разликите от сегашния решим са много
Национално спешно одобрение е позволено в ЕС, но Европейската комисия препоръча да не се използва този механизъм при ваксините не само защото съответната държава се натоварва с отговорност, ако нещо се обърка, но и защото бързането намалява способността на регулаторите да проверят данните за ефективността и безопасността. Освен това така се засилва и нежеланието на населението да се ваксинира, което и без това е голямо в някои държави.
При условното одобрение за пазара, благодарение на което в ЕС има одобрени три ваксини, процедурата е с повече изисквания от спешното разрешение за лекарства за тесен кръг умиращи хора, включително защото с ваксини биват инжектирани милиони здрави хора и рискът е много по-голям.
Дори при условното пазарно разрешение (то е със срок от една година) е преценено, че ползите са повече от известните рискове от ваксината, но от създателите се изисква да продължат да предоставят нови данни. При нормалното разрешение за излизане на пазара всички данни се предоставят предварително.
С одобряването от всички страни членки на Стратегията за ваксиниране в ЕС те се съгласяват и с изисквания като непрекъснат контрол над производството по същите стандарти като при нормално одобрение за излизане на пазара, правна отговорност на компанията, която е длъжна да има и план за управление на риска и разпространяване на условията за употреба на всички езици на ЕС в електронен вариант.
Спешното разрешение е нещо доста по-различно - за временна употреба на лекарство при специфични обстоятелства и докато съществува спешната ситуация.
Медикаментът не е лицензиран, не може да се изкарва на пазара, прилага се само на територията на конкретна страна член, поемаща и отговорността за това.
Законите на ЕС определят в този случай страната членка, препоръчала или изискваща такъв медикамент, изрично да снеме административната и гражданска отговорност от производителя и регулатора.
Занижени са и изискванията към производителя - всяка страна от ЕС сама решава при спешно одобрение за националните болници какви данни ще изиска за ваксината, какво ще наблюдава, нужен ли е мониторинг над процеса на производството ѝ, имат ли тези предприятия сертификат за добра прозиводствена практика, на базата на колко тествани доброволци се основават заключенията от клиничните изследвания и т.н.
Дневник

























Коментари
Анонимен
отговорността ще е на страните, които ги искат...
.................................................................................
сиреч починалите от вируса сами ще са си виновни
до Анонимен
Пак не си разбрал , починалите от не проверени и одобрени ваксини ,а не от вируса,ако искаш да не се заразяваш ще се пазиш
Анонимен
Представям си следният сценарий: Внасят от спутника, но междувременно го манипулират и в резултат- нови санкции!